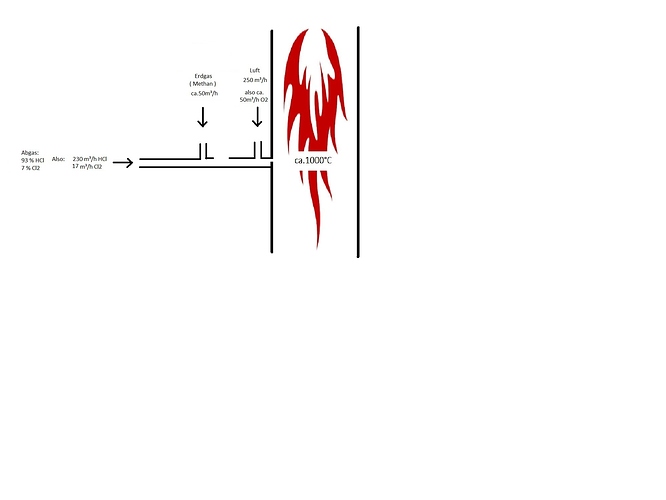
Hallo Leute,
Ich möchte in meinem Betrieb einen Verbesserungsvorschlag schreiben und mich nicht völlig blamieren, ich hoffe ihr könnt mir weiterhelfen, als Zusatz sind die Reaktionspartner fett gedruckt und eine Skizze angefügt ( und bitte kritisiert nicht die Richtigkeit hinsichtlich Verfahrenstechnik ect. , soll nur der groben Visualisierung dienen ). Also:
Zum Problem:
Es wird in einem Verbrennungsofen Abgas verbrannt, dieses strömt mit ca 250 m³/h in die Brennkammer - Zusammensetzung: 93% HCl und 7 % Chlor ( also ca. 17 m³/h Cl2 ). Zur Kühlung des Einleitrohres in die Brennkammer werden 250m³/h Luft eingeleitet ( also ca. 50m³/h O2 Anteil ). Der Chlor-Anteil verursacht kurz gesagt Probleme.
Nun zu meinem Vorschlag:
Ein gewisser Volumenstrom Methan sollte zum Abgasstrom zusätzlich eingeleitet werden, es werden nun also Luft, Methan, HCl und Cl2 zeitgleich als Mischung verbrannt. Meine Hoffnung dabei ist das nicht nur der Sauerstoff aus der Luft mit dem Methan reagiert, sondern auch das Cl2 zu HCl reagiert. Hier die angenommenen Reaktonsgleichungen:
CH4 + 2O2 -> CO2 + 2 H20
CH4 + CL2 -> HCl +CH3Cl (+ eine Palette Chlorierter Methane aller Markovnikov )
Für die 50 m³ O2 = 50000l / 22,4l = 2232 mol Sauerstoff benötige ich 1116 mol Methan
Für die 17 m³ CL2 = 17000l / 22,4l = 758 mol Chlor benötige ich 758 mol Methan
Gesamt also 1874 mol Methan welche ca. 42 m³ entsprechen, mit Sicherheits-Überschuss würde ich also ca.50 m³/h vorschlagen.
Bin ich mit den Reaktionsprodukten und der Stöchiometrie richtig ?
Ich hoffe ich habe nicht zu verwirrend beschrieben und ihr könnt mir weiterhelfen, vielen Dank schon einmal in Voraus